Zusammenführung von umfangreichen Daten und Vollständigkeit der Informationen zu Diagnose, Behandlung und zum Erkrankungsverlauf aus mehreren populationsbezogenen Krebsregistern in Deutschland – erste Erfahrungen am Beispiel von Lungenkrebs
Annika Waldmann 1Louisa Labohm 1
Hannah Baltus 1
Christine Eisfeld 2
Lina Jansen 3
Imma Löhden 4
Alice Nennecke 4
Florian Oesterling 2
Ron Pritzkuleit 5
Alexander Katalinic 1
1 Institut für Sozialmedizin und Epidemiologie, Universität zu Lübeck, Lübeck, Deutschland
2 Landeskrebsregister NRW gGmbH, Bochum, Deutschland
3 Epidemiologisches Krebsregister Baden-Württemberg, Deutsches Krebsforschungszentrum (DKFZ), Heidelberg, Deutschland
4 Hamburgisches Krebsregister, Freie und Hansestadt Hamburg, Behörde für Wissenschaft, Forschung, Gleichstellung und Bezirke, Hamburg, Deutschland
5 Krebsregister Schleswig-Holstein, Registerstelle, Lübeck, Deutschland
Zusammenfassung
Hintergrund: In Deutschland existiert eine flächendeckende Krebsregistrierung. Populationsbezogene Krebsregister sind auf Bundeslandebene organisiert. Bislang ist eine wissenschaftsgetriebene, anlassbezogene Zusammenführung von ausführlichen (klinischen) Daten zu Diagnose, Therapie und Verlauf aus mehreren Landeskrebsregistern nur selten erfolgt. Wir prüften die Machbarkeit und den Aufwand der Datenzusammenführung sowie die Eignung der Daten zur Deskription der onkologischen Versorgung.
Methoden: Daten zu Lungenkrebs (ICD-10 C34) aus den Diagnosejahren 2016–2019 wurden bei vier Landeskrebsregistern angefragt, aufbereitet und zusammengeführt. Sofern mehrere fallzuordnungsfähige Meldungen zu einer Therapie vorlagen, wurden diese im Rahmen des Pilotprojektes zur „besten Information“ aggregiert. Die Daten wurden deskriptiv und explorativ ausgewertet.
Ergebnisse: Die Datenaufbereitung und Zusammenführung waren zeitaufwändig, aber technisch gut machbar. Der Auswertungsdatensatz umfasst Informationen zu mehr als 61.000 Erkrankungsfällen mit mindestens einem Tag Nachbeobachtungszeit. Zu 74% liegen Informationen zu mindestens einer Therapieart (Operation, Strahlentherapie, systemische Therapie) vor. Die bereitgestellten Angaben zu den Details der Therapien sind überwiegend vollständig oder weisen nur wenig fehlende Werte auf.
Diskussion: Trotz z.T. föderaler Strukturen der Krebsregistrierung in den Ländern waren Unterschiede bezüglich der Datenverteilung und der Datenqualität im gepoolten Datensatz gering. Der Anteil mit vollständig fehlenden Angaben zur Therapie ist mit 26% als unseres Erachtens hoch zu bewerten, aber vergleichbar mit anderen Registerstudien. Auf Basis der vorhandenen Informationen können die Grundzüge einzelner onkologischer Therapien beschrieben und für die onkologische Versorgungsforschung genutzt werden.
Schlüsselwörter
populationsbezogene Krebsregister, Datenzusammenführung, Datenqualität, Therapie, Nachbeobachtung
Einleitung
Mit dem Gesetz zur Weiterentwicklung der Krebsfrüherkennung und zur Qualitätssicherung durch klinische Krebsregister wurde 2013 in Deutschland die Basis zur flächendeckenden klinischen Krebsregistrierung geschaffen, die heute in § 65c des Sozialgesetzbuches V abgebildet ist [1], [2]. Landesspezifische Krebsregistergesetze [3], [4], [5], [6] und § 8 des Bundeskrebsregisterdatengesetzes (BKRG) [7] regeln u.a. Datenverarbeitung, Meldewege und -anlässe. Der onkologische Basisdatensatz (oBDS) und ergänzende Module [8], [9], [10], [11] regeln Art und Umfang der zu registrierenden Daten.
Das Gesetz zur Zusammenführung von Krebsregisterdaten aus dem Jahr 2021 [12] bildet die Grundlage für die bundesweite Zusammenführung eines Teils der klinischen Daten am Zentrum für Krebsregisterdaten (ZfKD) in den ‚bundesweiten klinischen Krebsregisterdatensatz‘ [13]. Als erste Stufe wurden im Jahr 2023 erstmals Daten zu Therapie und Verlauf aus den Landeskrebsregistern zusammengeführt [13]. Auf Antrag können die bundesweiten Daten als Einzelfalldaten bereitgestellt werden. Diese Daten umfassen nicht alle Variablen des oBDS, so fehlen z.B. Angaben aus den organspezifischen Modulen sowie zu Biomarkern und zu Leistungserbringern. Für tiefergehende Analysen müssen deshalb weiterhin Landeskrebsregisterdaten genutzt werden. In einer zweiten Stufe sollen anlassbezogene, patienten- und leistungserbringerbezogene, registerübergreifende Zusammenführungen von Krebsregisterdaten realisiert werden [12]. Für diese Stufe steht ein konkretes Konzept noch aus.
Eine Zusammenführung von ausführlichen klinischen Daten zur Therapie und zum Krankheitsverlauf aus mehreren deutschen Landeskrebsregistern erfolgte – mit Ausnahme der Auswertungen, die regelmäßig anlässlich des Deutschen Krebskongresses vorgenommen werden und dort unter dem Begriff „Bundesweite Onkologische Qualitätskonferenz“ vorgestellt werden [14] – zunächst selten. Inzwischen beginnen einzelne Forschungsprojekte nationale klinische Daten zusammenzustellen [15], [16].
In einem Pilotprojekt wollten wir Machbarkeit und Aufwand einer Zusammenführung sowie die Dateneignung zur Deskription der onkologischen Versorgung prüfen. Es wurden Tumor-, Therapie- und Verlaufsdaten zu Personen mit Lungenkrebs aus vier Landeskrebsregistern angefordert, aufbereitet und zur Beantwortung folgender Fragestellungen genutzt:
- Wie groß ist der Aufwand der Datenzusammenführung?
- Sind die im Register bekannten Behandlungen vollzählig dokumentiert, sodass sie für eine Deskription der onkologischen Versorgung geeignet sind?
Methoden
Datenanforderung
Für das Pilotprojekt wurden die Landeskrebsregister von Baden-Württemberg, Hamburg, Nordrhein-Westfalen und Schleswig-Holstein kontaktiert, da sie entsprechende Daten mindestens seit dem Jahr 2016 erfassen. Bei der Auswahl dieser Register spielten außerdem folgende Überlegungen eine Rolle: es sollten (1) maximal zwei unterschiedliche Krebsregister-Softwaretypen verwendet werden, (2) Krebsregister mit großer wie auch mit kleiner zugrundeliegender Bevölkerung und (3) Stadtstaaten und Flächenländer zur Datenbasis beitragen.
Zum Jahreswechsel 2020/2021 wurde das Vorgehen der Datenanforderung abgestimmt und zusätzlich zu den registerspezifischen Formularen ein allgemeines Studienprotokoll und eine Variablenliste an die Register gesendet. Die Liste enthielt die angefragten Variablen aus dem oBDS mit Wunschformat (numerisch, String).
Beantragt wurden Informationen zu Erkrankungsfällen mit Lungenkrebs (ICD-10 C34) aus den Diagnosejahren 2016–2019. Die Erkrankten mussten mindestens 18 Jahre sein und im Register mussten Mindestangaben zur Diagnose vorliegen. Außerdem mussten die Erkrankten bei Diagnose im jeweiligen Bundesland leben – dies entsprach einer Selektion auf so genannte wohnortbezogene Fälle, die eine systematische Erhebung des Vitalstatus über einen Abgleich mit Meldeamtsinformationen bzw. Mortalitätsdaten erlauben [17].
Datenbereitstellung und Aufbereitung
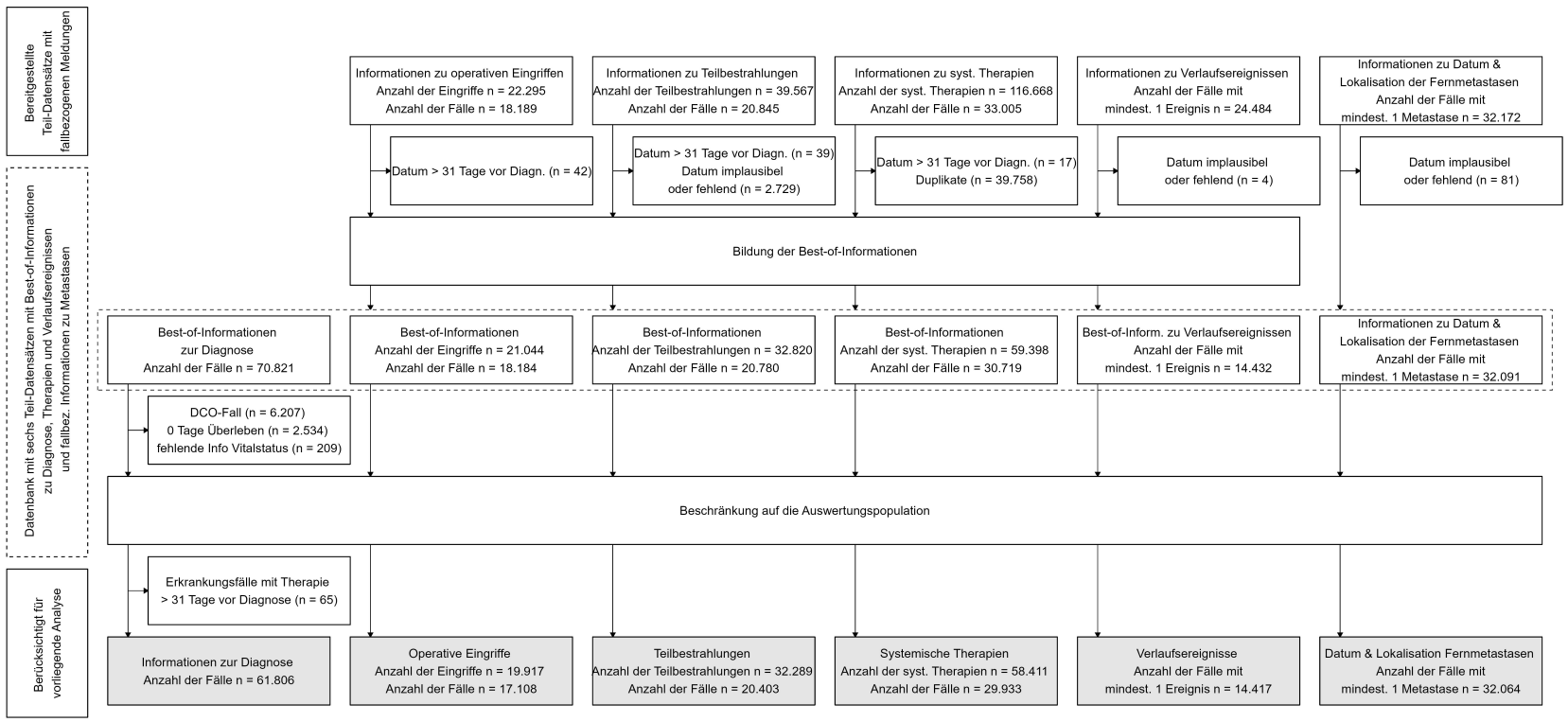
In den Registern liegen die Daten in relationalen Datenbanken in zwei unterschiedlichen Formen vor. Zum einen enthalten die Datenbanken „Rohdaten“ in Form von fallzuordnungsfähigen Meldungen, wie sie von Meldenden an das Register übermittelt werden. Diese Meldungen erfolgen zu bestimmten Meldeanlässen (z.B. Diagnose, Operation, Start einer Strahlentherapie etc.) und enthalten üblicherweise nur Daten, die diesem Anlass zuzuordnen sind (z.B. enthalten OP-Meldungen keine Angaben über eine begleitende systemische Therapie). Zu einem Meldeanlass können mehrere Meldungen von unterschiedlichen Meldenden vorliegen (z.B. eine Diagnosemeldung aus einer Praxis und einer spezialisierten Klinik). Zum anderen enthalten die Krebsregister-Datenbanken sogenannte „Best-of-Informationen“. Dies sind Zusammenfassungen von mehreren Meldungen (zur Best-of-Bildung siehe nächster Abschnitt), die letztendlich den Verlauf eines Erkrankungsfalls abbilden. Ein Best-of-Datensatz hat verschiedene 1:n-Verbindungen – 1 Patient : n Tumoren, 1 Tumor : n Therapien (Abbildung 1 [Abb. 1]).
Abbildung 1: Teil-Datensätze der flächendeckenden klinischen/behandlungsortbezogenen Krebsregistrierung – Relation der Datensätze zueinander sowie exemplarischer Inhalt und Skizzierung des Vorgehens bei der Bildung der „besten Information“ auf Basis von fallzuordnungsfähigen Meldungen
Im Teil-Datensatz „Best-of Information Tumorangaben“ gibt es für jeden Erkrankungsfall genau eine Zeile im Datensatz. In den Best-of-Datensätzen zur Therapie gibt es für jeden Therapieanlass (z.B. Operation des Primärtumors, Revisionsoperation, eine Teilbestrahlung im Rahmen einer Strahlentherapie) genau eine Zeile, allerdings kann ein Erkrankungsfall bei Vorhandensein mehrerer Therapieanlässe mehrfach im Datensatz vorkommen (1:n-Relation).
Bei Datenbeantragung lagen in den Registern noch nicht für alle Episoden eines Krankheitsverlaufs Best-of-Informationen vor, so dass z.T. fallzuordnungsfähige Meldungen übermittelt wurden und die Aufgabe der Best-of-Bildung im Pilotprojekt lag. Angaben zur Diagnose, also der Beschreibung des Primärtumors (Tumordaten), wurden aus allen Registern als Best-of-Informationen geliefert, bei den Therapien und Verläufen war das nicht immer der Fall (Tabelle 1 [Tab. 1]). Die zur Verfügung gestellten Teil-Datensätze wurden im „long-Layout“ (Daten in gestapelter Struktur; d.h. wurde ein Erkrankungsfall zweimal operiert, dann gab es für diesen Erkrankungsfall zwei Zeilen im Datensatz) oder im „wide-Layout“ (ungestapelte Struktur; d.h. wurde ein Erkrankungsfall zweimal operiert, dann wurden die Spalten mit den Informationen zur Operation verdoppelt und jeder Erkrankungsfall war mit einer Zeile im Datensatz enthalten) bereitgestellt. Im Zuge der Aufbereitung wurden alle Teil-Datensätze in ein gestapeltes Layout überführt.
Tabelle 1: Beschreibung der bereitgestellten Daten und von Besonderheiten bei der Datenbereitstellung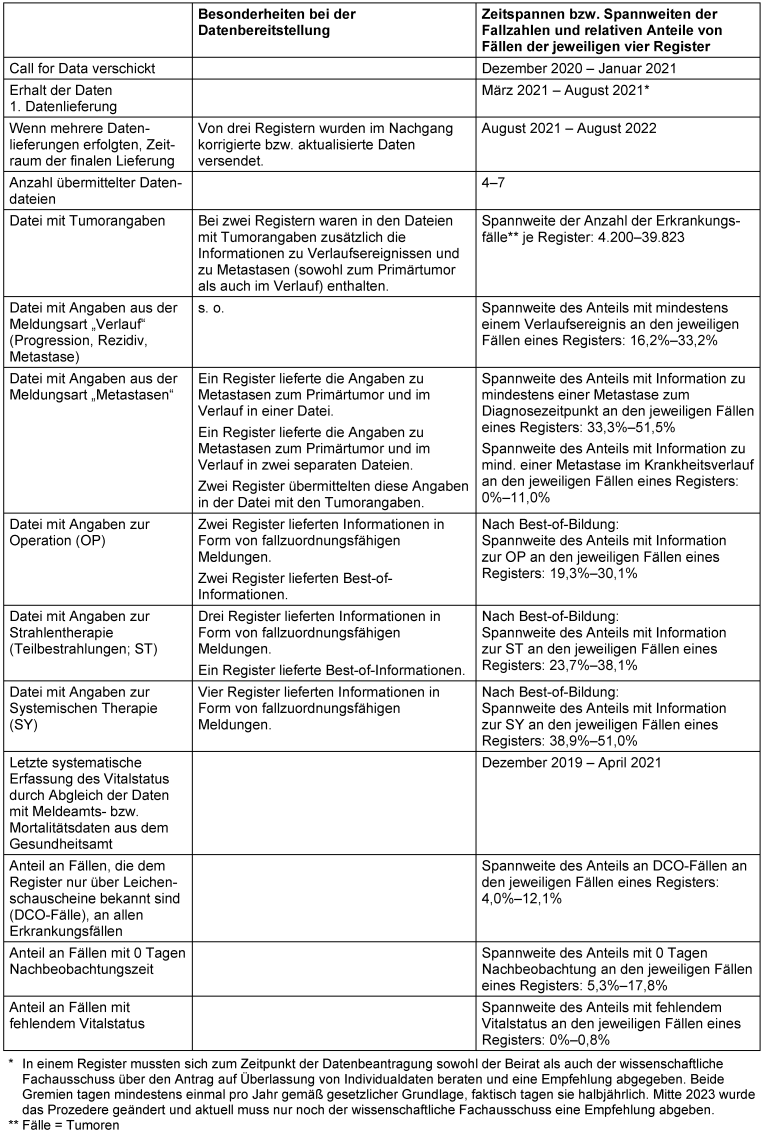
Angaben zu Substanzen oder Protokollen der systemischen Therapie werden den Registern über Freitextfelder gemeldet, wobei laut Datensatzbeschreibung des oBDS [11] Substanzen und Handelsnamen der Produkte erlaubt sind. Für die Aufbereitung dieser Angaben wurde eine von den Krebsregistern abgestimmte Substanz-Referenzliste verwendet, die neben der Standardisierung von Substanzen auch die Zuordnung zu den Therapiearten (Chemo-, Immuntherapie etc.) erlaubt. Die Angaben zur Art des operativen Eingriffs gelangen über Textfelder, in die entsprechend der Datensatzbeschreibung [11] so genannte OPS-Codes (Operationen- und Prozedurenschlüssel [18]) eingetragen werden sollen, in die Register. Für die Entscheidung, ob ein OPS-Code auf eine tumorresezierende Operation hinweist, wurde ebenfalls eine von den Krebsregistern abgestimmte OPS-Referenzliste verwendet.
Bildung von Best-of-Informationen
Angaben zur gleichen Information von mehreren Meldenden müssen zu so genannten Best-of-Informationen zusammengefasst werden (Abbildung 1 [Abb. 1]). Für die Diagnoseinformationen (Tabelle Tumordaten) gibt es seit vielen Jahren Empfehlungen zur (epidemiologischen) Best-of-Bildung – basierend auf internationalen Richtlinien und Übereinkünften der Landeskrebsregister – und die Umsetzung der Empfehlung ist in den Registern etabliert [17]. Da solche Richtlinien für Therapieangaben zu Beginn der flächendeckenden klinischen Krebsregistrierung in Deutschland nicht existierten, hat eine Arbeitsgruppe der Krebsregister Empfehlungen zur Best-of-Bildung in den Registern erarbeitet (Datum der Verabschiedung für die Empfehlungen zur OP: 07.05.2019; Strahlentherapie: 05.11.2019; systemische Therapie: 11.01.2022). Sofern registerseits keine Best-of-Therapieinformationen bereitgestellt wurden, wurden sie auf Basis der Einzelmeldungen und der AG-Empfehlungen (Stand Frühjahr 2021) in einem zeit- und programmieraufwändigen Verfahren generiert. Hierbei wurde z.B. bei Vorliegen von Start- und Endmeldung einer Therapie mit diskordanten Informationen zu einem Merkmal das vorgeschlagene „Ranking“ von Ausprägungen umgesetzt.
Datenverarbeitung und statistische Auswertungen
Die bereitgestellten Datensätze wurden mit dem Open Source Statistikprogramm R (Version 4.1.3) [19] aufbereitet, zusammengeführt und ausgewertet. Die Aufbereitungsschritte (u.a. Normierung von Variablennamen, -formaten und ggf. der Kodierungen, ggf. Best-of-Bildung) wurden für jedes Register separat vorgenommen. Sowohl die Roh-Datensätze als auch die durch die Bearbeitung und Zusammenführung entstandenen Datensätze wurden auf Datenqualität und Plausibilität geprüft. Die Variablen in den gepoolten Datensätzen wurden zusätzlich auf mögliche Registereffekte, d.h. auf Unterschiede in der Häufigkeitsverteilung der Merkmalsausprägungen zwischen den Registern, geprüft.
Zur Beurteilung der Datenhomogenität werden für die prozentualen Häufigkeiten und Mediane das Minimum und das Maximum der Werte aus den vier Registern angegeben.
Für die Analysen wurden Fälle, die dem Register nur auf Basis eines Leichenschauscheins (DCO-Fall) bekannt waren, Fälle mit 0 Tagen Überleben, Fälle mit fehlenden Informationen zum Vitalstatus und Fälle mit Informationen zu Therapien, die zeitlich mehr als 31 Tage vor der Lungenkrebsdiagnose lagen und die als Hinweis auf weitere Krebserkrankungen gedeutet werden können, ausgeschlossen.
Eine statistische Hypothesentestung war nicht intendiert.
Ethik
Das Vorhaben wurde bei der Ethikkommission der Universität zu Lübeck angezeigt und zustimmend zur Kenntnis genommen (Az 20-483). Im Deutschen Register Klinischer Studien ist es unter der Nummer DRKS00025080 registriert [20].
Ergebnisse
Datenbereitstellung und Aufbereitung
Tabelle 1 [Tab. 1] verdeutlicht die Heterogenität der Datenbereitstellung. Zwei Register übermittelten die Daten zeitnah, während ein Register sieben Monate benötigte. Die Anzahl der bereitgestellten Teil-Datensätze und deren Layout unterschied sich u.a. aufgrund vager Vorgaben im Antrag auf Datenübermittlung.
Informationen zu operativen Eingriffen wurden von zwei Registern und Informationen zur Strahlentherapie wurden von einem Register als Best-of-Information zur Verfügung gestellt. Die Informationen zu systemischen bzw. abwartenden Therapien (im Folgenden „systemische Therapie“) wurden von allen Registern als fallzuordnungsfähige Meldungen übermittelt.
Alle hier einbezogenen Register erheben den Vitalstatus systematisch und in ähnlicher Weise durch einen regelmäßigen Abgleich der Krebsregisterdaten mit Meldeamtsinformationen bzw. Mortalitätsdaten. Der jeweils letzte Abgleich für den hier genutzten Datensatz erfolgte in einem Register im Dezember 2019, in einem weiteren im Dezember 2020 und in den zwei anderen Registern im Jahr 2021.
Datengrundlage: Gepoolter Datensatz mit „Best-of-Informationen“
Nach Aufbereitung, Best-of-Bildung und Zusammenführung lag eine Datenbank mit sechs Teil-Datensätzen für insgesamt 70.821 Erkrankungsfälle vor (Tabelle 1 [Tab. 1], Abbildung 2 [Abb. 2]): Je ein Datensatz mit Best-of-Informationen zur Diagnose (und zum Vitalstatus), Operationen, Strahlentherapien, systemischen Therapien (die entweder nur aus einer Therapieart wie bspw. Chemotherapie oder einer Kombination aus Therapiearten bestehen können) bzw. mit Verlaufsinformationen und ein weiterer mit Informationen zu Metastasen zum Zeitpunkt des Primärtumors und im Verlauf.
Die Auswertungen beruhen auf 61.806 Fällen nach Anwendung der Ausschlusskriterien.
Vollzähligkeit der dokumentierten Therapien: Erkrankungsfälle mit und ohne bekannte Therapie
Bei 45.465 der 61.806 Fälle (73,8%) lagen Informationen zu mindestens einem Therapieereignis vor. Diese Erkrankungsfälle waren im Vergleich zu Fällen ohne Informationen zur Therapie im Median 4 Jahre jünger, hatten seltener ein fehlendes Tumorstadium, seltener großzellige und etwas häufiger kleinzellige Lungenkarzinome und verstarben seltener im Beobachtungszeitraum (Tabelle 2 [Tab. 2]).
Tabelle 2: Beschreibung der Lungenkrebsfälle (ICD-10 C34, Diagnosejahre 2016–2019) insgesamt und nach Vorhandensein von mind. 1 Therapieinformation
(absolute und relative Häufigkeit bezogen auf die jeweilige Zeile, sofern nicht anders angegeben)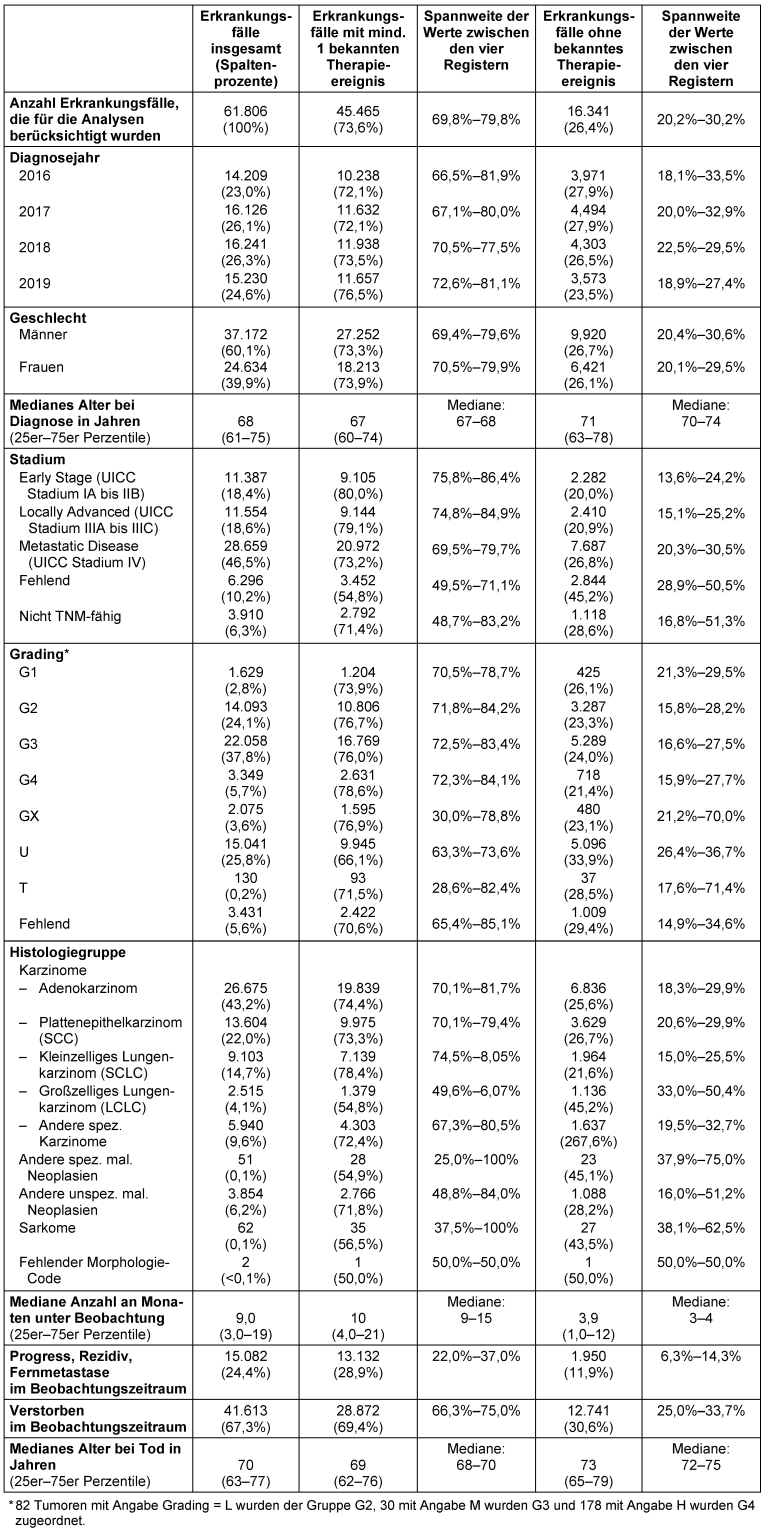
Bei bekannter Therapie lagen am häufigsten Informationen zur alleinigen systemischen Therapie (n=12.560; 27,6%), zu einer Kombination von Strahlen- und systemischer Therapie (n=10.081; 22,2%) und zur alleinigen Operation (n=8.641; 19,0%) vor (Abbildung 3 [Abb. 3]).
Abbildung 3: Anzahl an Erkrankungsfällen ohne bzw. mit Best-of-Informationen zur Therapie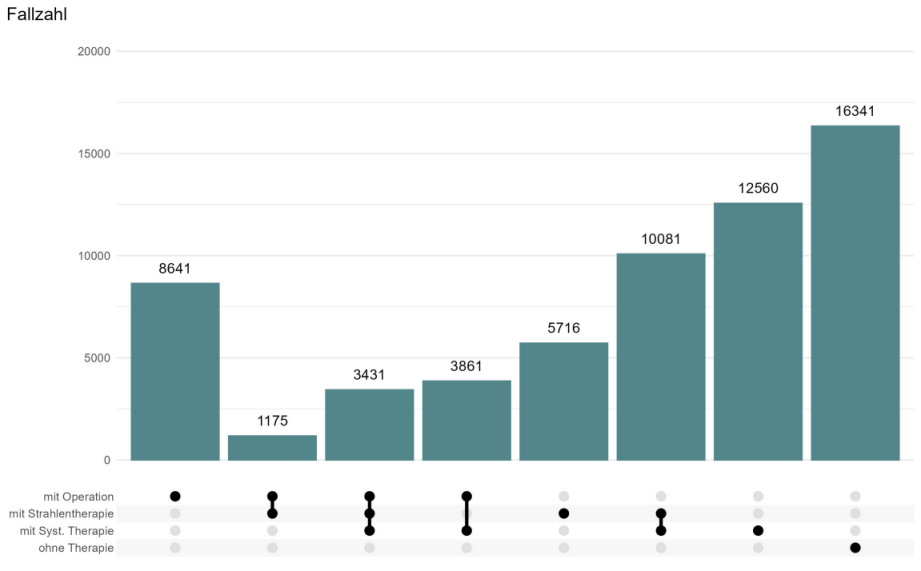
Datengrundlage sind die 61.806 Erkrankungsfälle unter Anwendung der Ausschlusskriterien. Für einen Erkrankungsfall können entweder keine, eine oder eine Kombination mehrerer Therapiearten im Krebsregister bekannt sein.
Vollständigkeit der Angaben zu den dokumentierten Therapien
Insgesamt lagen Informationen zu 19.917 operativen Eingriffen vor. Mindestens ein operativer Eingriff war für 27,7% der Erkrankungsfälle in der Auswertungspopulation bekannt (Abbildung 2 [Abb. 2], Tabelle 3 [Tab. 3]). Dieser Anteil variierte zwischen den Registern im Bereich von 20,2% bis 31,1%. Rund 79,2% aller Eingriffe erfolgten innerhalb von 6 Monaten nach Diagnosestellung (92,2% aller Ersteingriffe). Nach Bildung der Best-of-Informationen fehlten selten konkrete Angaben zur Intention der Operation (fehlende Angabe oder Ausprägung „unbekannt“: 12,2%) und zu Operationsprozeduren (1,0%), während Angaben zu Komplikationen der Operation zu mehr als 50% fehlend oder unbekannt waren. Für die Register waren die Verteilungen der Merkmalsausprägungen überwiegend recht ähnlich (Tabelle 3 [Tab. 3] – Abschnitt A). In rund 95% der Fälle mit Informationen zur Operation waren gültige Angaben zu Datum, Intention und den erfolgten Prozeduren enthalten. Dieser Anteil variierte zwischen den Registern im Bereich von 85,0% bis 100%.
Tabelle 3: Anzahl an Fällen mit Best-of-Informationen und Vollständigkeit der Angaben zur Therapie
(absolute und relative Häufigkeit, sofern nicht anders angegeben)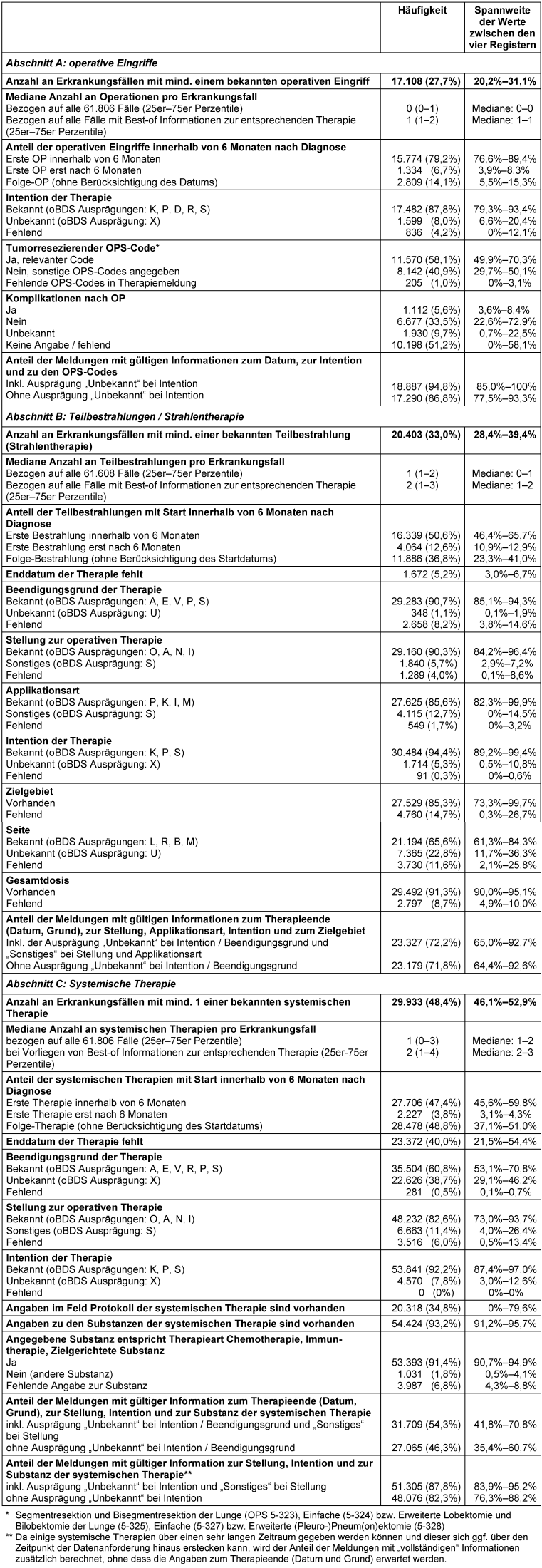
Für 33,0% der Erkrankungsfälle in der Auswertungspopulation lag mindestens eine Information zur Teilbestrahlung im Rahmen einer Strahlentherapie vor (Abbildung 2 [Abb. 2], Tabelle 3 [Tab. 3]). Rund 50,6% aller Teilbestrahlungen wurden innerhalb von 6 Monaten nach Diagnosestellung begonnen (80,1% aller Erst-Teilbestrahlungen). Für mehr als 90% lagen Angaben zur Gesamtdosis der Teilbestrahlung vor. Mit Ausnahme der Angaben zur Seite des Zielgebietes (unbekannt: 22,8%, fehlend: 14,7%) lag der Anteil fehlender Werte bei maximal 15%. Auch für die Angaben aus den Meldungen zu den Teilbestrahlungen gilt, dass die Häufigkeitsverteilungen im Registervergleich überwiegend recht ähnlich waren (Tabelle 3 [Tab. 3] – Abschnitt B). Insgesamt enthielten rund 72% dieser Best-of-Informationen gültige Angaben zu Start und Ende der Therapie, Stellung zur Operation, Applikationsart, Intention und Zielgebiet (Streuung zwischen den Registern: 65,0%–92,7%).
Mindestens eine Best-of-Information zur systemischen Therapie konnte für 48,4% der Erkrankungsfälle gebildet werden (Abbildung 2 [Abb. 2], Tabelle 3 [Tab. 3]). Rund 47,4% aller systemischen Therapien wurden innerhalb von 6 Monaten nach Diagnosestellung begonnen (92,6% aller Erst-Therapien). Information zum Enddatum der Therapie und zum Beendigungsgrund (unbekannt oder fehlend) fehlten zu je ca. 40%. In rund 93% der Best-of-Informationen konnte mindestens eine Substanz der systemischen Therapie über die Substanz-Referenzliste den Therapiearten Chemo-, Immuntherapie oder Zielgerichtete Therapie zugewiesen werden. Im Registervergleich zeigte sich, dass die Angaben zur systemischen Therapie überwiegend recht ähnlich waren (Tabelle 3 [Tab. 3] – Abschnitt C). Größere Unterschiede zeigten sich für die Informationen zu den Protokollen der systemischen Therapie – sowohl der Befüllungsgrad als auch der Inhalt des Feldes variierte deutlich. Angaben zu den Protokollen waren nur selten zu finden, stattdessen wurden häufig die Angaben aus dem Feld Substanzen wiederholt oder ergänzt z.B. um weitere Substanzen oder Dosierungen bzw. Applikationsarten. Insgesamt enthielten rund 88% der Best-of-Informationen zur systemischen Therapie gültige Angaben zu Start, Stellung zur Operation, Intention und verabreichten Substanzen (Streuung zwischen den Registern: 83,9%–95,2%).
Diskussion
In zunehmendem Maße werden von den Krebsregistern in Europa Behandlungsdaten erhoben und berichtet, allerdings mit derzeit noch großer Heterogenität bezüglich der erfassten Daten und der Datenqualität [21]. In Deutschland liegen in den behandlungsortbezogenen (klinischen) Landeskrebsregistern umfangreiche Daten zu Diagnose, Therapie und zum Erkrankungsverlauf von Krebserkrankungen, die im Einzugsgebiet des jeweiligen Krebsregisters aufgetreten und therapiert worden sind, vor. Eine Datenzusammenführung von (ausführlichen klinischen) Registerdaten auf Basis des oBDS war zum Zeitpunkt der Studie noch nicht geschehen. Aus diesem Grund prüften wir in einem Pilotprojekt Machbarkeit und Aufwand der Datenzusammenführung sowie die Dateneignung mit einem Fokus auf Vollständigkeit der Angaben zur Deskription der onkologischen Versorgung am Beispiel von Lungenkrebs.
Datenzusammenführung und Bildung der besten Information
Zum Zeitpunkt der Projektplanung und -durchführung gab es noch keinen ‚bundesweiten klinischen Krebsregisterdatensatz‘ mit Informationen zur Therapie und zu Verlaufsereignissen [13], der beim ZfKD angefordert werden konnte, so dass die Daten bei den Krebsregistern beantragt werden mussten.
Außerdem gab es weder ein einheitliches Antragsformular noch ein gemeinsames Antragsportal, was die Beantragung erschwerte. Mittlerweile ist ein einheitliches Antragsformular von der Plattform § 65c entwickelt worden (Beschlussnummer 2024/70/06), wodurch sich der Aufwand für die Datenbeantragung verringert hat. Die Entwicklung und dauerhafte Implementierung eines gemeinsamen Antragsportal für die Daten aus unterschiedlichen Krebsregistern, wie sie derzeit im Projekt AI-Care angestrebt wird [22], ist wünschenswert und könnte den Aufwand der Datenbeantragung zukünftig weiter reduzieren.
Der Prozess der Datenaufbereitung, Harmonisierung und Zusammenführung war mit einer Dauer von neun Monaten von der Datenbeantragung bis zur ersten Version einer qualitätsgesicherten Datenbank mit sechs (Teil-)Datensätzen sehr zeitaufwändig. Unter anderem trugen zu vage formulierte Vorgaben bei der Datenbeantragung zu Struktur und Inhalt von Teil-Datensätzen sowie die noch nicht überall umgesetzte Bildung der „besten Therapie-Information“ und die abweichenden Zeitfenster „Beantragung bis Übermittlung der Daten“ zum hohen Aufwand bei. Der Grund für die starke Abweichung der Zeitfenster liegt u.a. darin, dass zum Zeitpunkt der Datenbeantragung in einem Bundesland im Falle eines Antrags auf Überlassung von Individualdaten zunächst ein Beirat und ein wissenschaftlicher Fachausschuss der Datenübermittlung über den Antrag beraten und eine Empfehlung abgeben mussten. Beide Gremien tagen gemäß gesetzlicher Grundlage mindestens einmal pro Jahr [5] – aktuell tagen sie regelhaft halbjährlich. Mitte 2023 wurde dieses Prozedere geändert und aktuell muss in diesem Bundesland nur noch der wissenschaftliche Fachausschuss über den Antrag beraten.
In Bezug auf die Struktur und das Format der Datensätze waren im Antrag auf Datenbereitstellung nur implizit Vorgaben gemacht worden, u.a. um es den Krebsregistern zu erlauben, auf gegebenenfalls vorhandene Datenextraktionsroutinen zurückgreifen zu können. Um den Arbeitsaufwand bei der Datenvereinheitlichung und -zusammenführung klein zu halten, empfiehlt sich eine intensive Absprache mit den Registern zu Anzahl, Format und konkretem Inhalt der angefragten Datensätze sowie zu den Ein- und Ausschlusskriterien.
Start und Ende der Strahlen- und der systemischen Therapie sind in der behandlungsortbezogenen Krebsregistrierung in vielen Bundesländern getrennte Meldeanlässe. Deswegen muss bei der Bildung der besten Information geprüft werden, ob erwartungsgemäß zwei Meldungen zu einem Therapieanlass vorliegen und ob Angaben logisch zusammenpassen bzw. in welcher Meldung überhaupt eine oder die „bessere“ Information steht. Bei Vorliegen von Start- und Endmeldung, aber abweichenden Angaben zu einem Merkmal kann auf Basis definierter Algorithmen (z.B. anhand der von den Krebsregistern erarbeiteten Empfehlungen zur Best-of-Bildung) entschieden werden, welche Angabe jeweils in die Best-of-Information übernommen wird. Die Therapiedaten wurden überwiegend (im Falle der systemischen Therapie von allen Registern) in Form von fallzuordnungsfähigen Meldungen bereitgestellt. Die Komplexität der Programmierung der Best-of-Bildung der Therapieereignisse trug erheblich zum Aufwand der Datenaufbereitung bei. Sobald die Register für alle Therapiearten Best-of-Informationen bereitstellen können, wird sich der Aufwand deutlich reduzieren. Da seit dem Jahr 2022 fallbasierte (und nicht meldungsbasierte) Informationen durch die Krebsregister an das ZfKD geliefert werden [13], ist davon auszugehen, dass die Best-of-Bildung in den Krebsregistern aktuell weitestgehend flächendeckend und für alle Meldungsarten umgesetzt ist. Ob diese auch die komplexe Abgrenzung von Mehrfachtherapien, wie First- und Second-Line-Therapien umfassen wird, bleibt abzuwarten.
Die Analysen auf Ebene der Best-of-Informationen erlauben neben Aussagen zur Vollständigkeit der Informationen auch – sofern die Therapien vollzählig gemeldet werden – Aussagen über typische Behandlungsmuster und Überleben nach bestimmten Therapien. Dabei gilt es zu bedenken, dass sich die Krebsregisterdaten mit ihrer vorgegebenen Struktur und definierten Merkmalsausprägungen – anders als individuelle klinische Fallakten – der klinischen Komplexität eines Falles nur annähern können.
Vollzähligkeit der dokumentierten Therapien
Der Anteil an Fällen mit Informationen zu mindestens einer Therapieart (74%) ist unseres Erachtens aktuell noch zu niedrig, liegt aber in vergleichbar Höhe wie bspw. in den Daten aus dem SEER-Register (78,5% bei nicht-kleinzelligem Lungenkrebs [NSCLC] bzw. 75,1% bei NSCLC in der Altersgruppe 80 Jahre und älter) [23], [24]. Ob bei den Fällen ohne bekannte Therapie lediglich die Information (Meldung) zum Zeitpunkt der Datenübermittlung im Register fehlt oder ob die Therapie nicht durchgeführt wurde, bleibt derzeit offen. Für Personen mit NSCLC im Stadium III kann auf Basis einer Analyse aus Zentraleuropa davon ausgegangen werden, dass rund 5% mit „Best Supportive Care“ versorgt werden [25] – dies sind Therapien, die möglicherweise nicht konsequent an die Krebsregister gemeldet werden. Die Vollzähligkeit von Therapiemeldungen soll im Rahmen einer weiteren Analyse ausführlicher untersucht werden
Vollständigkeit der Angaben zu den dokumentierten Therapien
Sofern dem Register eine Therapie bekannt ist, kann insbesondere für die operativen Eingriffe von einer hohen Vollständigkeit (rund 95%) der wesentlichen Informationen ausgegangen werden. In der Gesamtschau liegt nur bei wenigen Variablen ein hoher Anteil fehlender Werte vor. Zu nennen sind hier die Angaben zu Komplikationen nach operativen Eingriffen und zu den Nebenwirkungen einer Strahlen- oder systemischen Therapie. Ein „Reporting Bias“ (Verzerrung durch selektive Dokumentation) kann diverse Ursachen haben und an verschiedenen Stellen des Dokumentationsprozesses entstehen: Das Auftreten unerwünschter Ereignisse ist kein eigener Meldeanlass nach landesrechtlichen Bestimmungen der involvierten Krebsregister [3], [4], [5], [6]). Zudem sieht der oBDS ohnehin nur die Meldung von unerwünschten Ereignissen, die innerhalb von 90 Tagen nach Therapie auftreten, vor; während diese in der klinischen Realität häufig erst später auftreten. Weiterhin sind die Angaben in den involvierten Registern keine „Mindestangabe“ bzw. kein Pflichtfeld bei der Meldung [26], [27], [28], daher kann ein selektives Nichtdokumentieren von „keine Komplikation“ zum Zeitpunkt der Meldung zu Datenverzerrungen führen. Eine kürzlich veröffentliche Studie zu NSCLC und Immuntherapie deutet auf weitere Gründe für den hohen Anteil fehlender Werte hin: Neben der Angst vor dem Abbruch der Therapie sind hauptsächlich die individuelle Einschätzung der Schweregrade und die Machbarkeit des Umgangs mit ihnen dafür verantwortlich, dass Komplikationen oder Nebenwirkungen von Erkrankten nicht gegenüber dem behandelndem Team geäußert und damit auch nicht dokumentiert werden [29]. Hinweise auf ein systematisches Fehlen von Angaben finden sich in den Daten in der US-amerikanischen National Cancer Database. Hier geht ein hoher Anteil fehlender Angaben mit einem schlechteren Überleben einher [30].
Fehlen die Informationen zum Enddatum oder zum Beendigungsgrund in den Endmeldungen einer Therapie oder in den Best-of-Informationen (bei Vorliegen von Start- und/oder Endmeldung) oder fehlen diese Endmeldungen selber, kann dies als Qualitätsdefizit gewertet werden. Beim Antrag auf Datenbereitstellung sollte daher der Meldeanlass für die Therapien (Start oder Ende) angefragt werden – mit dieser Angabe lässt sich unterscheiden, ob Qualitätsdefizite für die Endmeldung vorliegen oder Endmeldungen für die Therapien fehlen. Für das Pilotprojekt wurde aus Datensparsamkeitsgründen auf diese Angabe verzichtet, so dass das Defizit nur indirekt überprüft werden kann. Meldungen zu systemischen Therapien, die in den Jahren 2020 und 2021 initiiert wurden, wiesen erwartungsgemäß deutlich höhere Anteile fehlender Werte zum Beendigungsgrund (49% bzw. 76%) auf als solche für Therapien mit Start in 2016 bis 2019 (35%–40%).
Die Krebsregistergesetze in Schleswig-Holstein und Nordrhein-Westfalen sehen eine Meldung innerhalb von 6 und in Hamburg von 8 Wochen nach Bekanntwerden der Diagnose bzw. Therapie vor, in Baden-Württemberg hat die Meldung spätestens im Folgequartal zu erfolgen [3], [4], [5], [6]. Deswegen und wegen der medianen Dauer der ersten bekannten systemischen Therapie von 64 Tagen bzw. einem Abschluss der Therapie bei 75% aller Fälle innerhalb von 105 Tagen, wäre zu erwarten gewesen, dass das Ende der Therapie und der Beendigungsgrund bei Datenlieferung im Jahr 2021 bekannt sein sollten. Jedoch kann es aufgrund von fehlenden oder noch ausstehenden Meldungen seitens der Behandelnden bzw. aufgrund von Bearbeitungsrückstau im Register zu fehlenden Informationen insbesondere bei aktuelleren Therapien kommen.
Leider melden die an der onkologischen Versorgung beteiligten Kliniken und Praxen Informationen zur Therapie noch nicht in dem Maße und in der Qualität, die für eine valide Deskription wünschenswert wären. Es fehlen aktuell beispielsweise bei 15% der Best-of-Informationen zu den Teilbestrahlungen die Angaben zum Zielgebiet der Bestrahlung und bei 9% die Angaben zur Gesamtstrahlendosis. Dies mag einerseits an mangelnden Ressourcen in den Kliniken und Praxen liegen, andererseits ist aber denkbar, dass zum Zeitpunkt der Meldung noch nicht alle Informationen zur Verfügung gestanden haben. In den gepoolten Datensätzen zeigte sich, dass die Register unterschiedlich streng bei der Daten-Entgegennahme sind und in variierendem Ausmaß fehlende oder zunächst als „unbekannt“ kodierte Informationen nachrecherchieren. So gibt es je nach Register unterschiedliche Variablen, in denen die Merkmalsausprägung „unbekannt“ im Vergleich zu den anderen Registern auffällig häufig vorkommen.
Während die SEER-Daten nur eine limitierte Anzahl an Merkmalen zu den Primärtherapien, die innerhalb der ersten 24 Monate in Kliniken begonnen wurden, beinhalten [31] und damit nicht das vollständige Bild der onkologischen Versorgung widerspiegeln [32], [33], umfassen die Daten aus den deutschen Krebsregistern nicht nur die Primär- sondern auch die weiteren Therapien sowohl aus dem stationären als auch dem ambulanten Sektor. Hierin liegt eine Besonderheit, die eine umfassende Deskription der onkologischen Versorgung auf Basis der Krebsregisterdaten erlaubt – unter der Annahme, dass alle Therapien (vollzählige Meldung) mit vollständigen und validen Angaben zu den per oBDS definierten Merkmalen (vollständige Meldungen) in die Landeskrebsregister gelangen.
Datenumfang des ‚bundesweiten klinischen Krebsregisterdatensatz‘ im Vergleich zu selbst beantragten Daten bei den Krebsregistern
Der aktuell zu beantragende ‚bundesweite klinische Krebsregisterdatensatz‘ umfasst nicht alle Variablen des oBDS, so fehlen z.B. Angaben zu Leistungserbringern und aus den organspezifischen Modulen sowie zu Biomarkern. Weiterhin fehlen einzelne Angaben zu den Therapien wie unerwünschte Ereignisse und Komplikationen oder auch die Dosisangaben zur Strahlentherapie und der Residualstatus nach Abschluss der Primärtherapie [13]. Für tiefergehende Analysen müssen daher auch weiterhin selbst beantragte Daten der Landeskrebsregister genutzt werden.
Ein weiterer Nachteil des ‚bundesweiten klinischen Krebsregisterdatensatzes‘ ist, dass das früheste verfügbare Diagnose- und Behandlungsjahr in diesem Datensatz das Jahr 2020 ist. Sofern die Therapie und das Überleben vor und nach Zulassung neuartiger Therapeutika untersucht werden soll (wie bspw. von Personen mit nicht-kleinzelligem Lungenkrebs vor und nach Zulassung der Behandlung mit Osimertinib bei vorliegender EGFR-Mutation [34] oder einer Kombination aus Nivolumab, Ipilimumab und zwei Zyklen platinbasierter Chemotherapie beim metastasierten NSCLC [35]), muss auch weiterhin auf die Daten der Landeskrebsregister zurückgegriffen werden, in denen Behandlung- und Verlaufsdaten auch für den Zeitraum vor dem Jahr 2020 vorliegen.
Fazit
In unserem Pilotprojekt zeigte sich, dass die Zusammenführung von klinischen Daten aus den Landeskrebsregistern zwar noch sehr (zeit-)aufwändig, aber technisch gut machbar war. Länderspezifische Unterschiede und unklare Angaben bei der Datenanforderung erschwerten und verlangsamten die Zusammenführung der Daten u.a. aufgrund unterschiedlicher Antragsprozeduren und Formate der bereitgestellten Daten insbesondere aber aufgrund der noch nicht vollständig umgesetzten Best-of-Bildung zu den Therapien in den Registern.
Die Datengenerierung unterliegt in den hier involvierten Bundesländern z.T. abweichenden (unterschiedliche Landesgesetzgebungen, Krebsregister-Software, Meldestrukturen und Registerroutinen), z.T. gemeinsamen Rahmenbedingungen (Meldepflicht, oBDS). Bei der Interpretation der Daten sollten diese berücksichtigt werden. Die Frage der Vollständigkeit bzw. das Fehlen von Angaben in Datenfeldern (Variablen) muss sorgfältig analysiert werden, insbesondere weil unklar ist, ob Daten zufällig oder systematisch in Abhängigkeit vom Krankheitsstadium, Allgemeinzustand oder Alter oder in Abhängigkeit des Versorgungsbereiches (ambulantes/stationäres Setting) fehlen.
In den gepoolten Datensätzen waren die Unterschiede zwischen den Bundesländern bezüglich Datenverteilung und Datenqualität gering. Mit vertretbarem Aufwand konnte eine bevölkerungsbezogene Datenbank generiert werden, die mit mehr als 61.000 Fällen hinreichend groß ist, um auch für seltene histologische Subgruppen oder Altersgruppen mit wenigen Erkrankungsfällen – unter der Voraussetzung valider und vollzähliger Informationen – aussagekräftige Auswertungen vornehmen zu können. Selbst bei Beschränkung auf Erkrankungsfälle mit Informationen zu mindestens einer Therapieart bzw. auf Erkrankungsfälle mit vollständigen (wesentlichen) Informationen der Therapie ergeben sich immer noch sehr hohe Fallzahlen. Diese Fallzahlen sind vergleichbar mit aktuell laufenden onkologischen Langzeit-Registerstudien [36].
Es bleibt zu hoffen, dass wegen der gesetzlich vorgeschriebenen Lieferung an das ZfKD Best-of-Informationen für die Therapien zeitnah in den Registern vorliegen werden. Dies wird dazu führen, dass die Zusammenführung von Daten zur Therapie und zum Verlauf aus den Landeskrebsregistern deutlich einfacher werden wird. Es bleibt abzuwarten, ob durch die Stufe 2 des Bundesgesetzes [12] die anlassbezogene Datenzusammenführung und -bereitstellung mittels einer Zentralen Antrags- und Registerstelle schneller vonstattengehen wird. Aber auch dann wird eine gute Kommunikation mit den Registern für die Datenauswertung und -interpretation bedeutsam sein.
Der Anteil mit gänzlich fehlenden Informationen zur Therapie ist unseres Erachtens mit ca. 26% noch recht hoch, aber vergleichbar zu anderen Registerstudien [23], [24]. Sofern Informationen zu den Therapien vorliegen, sind diese Angaben überwiegend hinreichend vollständig. Daher können die Grundzüge einzelner Therapien gut beschrieben und für die onkologische Versorgungsforschung genutzt werden. Mögliche Verzerrungen durch fehlende Angaben müssen aber berücksichtigt werden, insbesondere dann, wenn Schlussfolgerungen für die onkologische Versorgung aus Populationssicht gezogen werden sollen.
Anmerkungen
Danksagung
Die Autor*innen danken Volker Arndt aus dem Krebsregister Baden-Württemberg für seine kritischen und hilfreichen Hinweise zu früheren Versionen dieses Manuskripts.
Interessenkonflikte
Die Autoren erklären, dass sie keine Interessenkonflikte in Zusammenhang mit diesem Artikel haben. Sie weisen darauf hin, dass sie (mit Ausnahme von AW, LL, HB) in Landeskrebsregistern angestellt sind oder diese leiten.
Ethik
Für diesen Beitrag wurden keine Studien an Menschen durchgeführt. Die Richtlinien für das Auswerten von anonymisierten Daten wurden eingehalten. Das Forschungsvorhaben wurde bei der Ethikkommission der Universität zu Lübeck angezeigt.
Literatur
[1] Bundesregierung. Gesetz zur Weiterentwicklung der Krebsfrüherkennung und zur Qualitätssicherung durch klinische Krebsregister (Krebsfrüherkennungs- und-registergesetz – KFRG) vom 3. April 2013[2] Katalinic A, Halber M, Meyer M, Pflüger M, Eberle A, Nennecke A, Kim-Wanner SZ, Hartz T, Weitmann K, Stang A, Justenhoven C, Holleczek B, Piontek D, Wittenberg I, Heßmer A, Kraywinkel K, Spix C, Pritzkuleit R. Population-Based Clinical Cancer Registration in Germany. Cancers (Basel). 2023 Aug;15(15):3934. DOI: 10.3390/cancers15153934
[3] Landesregierung Baden-Württemberg. Gesetz über die Krebsregistrierung in Baden-Württemberg (Landeskrebsregistergesetz – LKrebsRG) vom 7. März 2006.
[4] Senat Freie und Hansestadt Hamburg. Hamburgisches Krebsregistergesetz (HmbKrebsRG) vom 27. Juni 1984.
[5] Landesregierung Nordrhein-Westfalen. Gesetz über die klinische und epidemiologische Krebsregistrierung im Land Nordrhein-Westfalen (Landeskrebsregistergesetz – LKRG NRW) vom 2. Februar 2016.
[6] Landesregierung Schleswig-Holstein. Gesetz über das Krebsregister des Landes Schleswig-Holstein (Krebsregistergesetz – KRG SH) vom 4. November 2015.
[7] Bundesregierung. Bundeskrebsregisterdatengesetz (BKRG) vom 10. August 2009 (BGBl. I S. 2702,2707) – zuletzt geändert durch Artikel 2 des Gesetzes vom 18. August 2021 (BGBl. I S. 3890).
[8] Bundesministerium für Gesundheit. Bekanntmachung: Module zur Dokumentation des Brust- und Darmkrebses in Ergänzung des aktualisierten einheitlichen onkologischen Datensatzes der Arbeitsgemeinschaft Deutscher Tumorzentren e.V. (ADT) und der Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (GEKID) vom 28. Oktober 2015. BAnz AT. 26.11.2015;(B1):1-10.
[9] Bundesministerium für Gesundheit. Bekanntmachung: Modul zur Dokumentation des Prostatakrebses in Ergänzung des aktualisierten einheitlichen onkologischen Datensatzes der Arbeitsgemeinschaft Deutscher Tumorzentren e. V. (ADT) und der Gesellschaft der epidemiologischen Krebsregister in Deutschland e. V. (GEKID) vom 9. August 2017. BAnz AT. 29.08.2017;(B6):1-6.
[10] Bundesministerium für Gesundheit. Bekanntmachung: Modul zur Dokumentation des Malignen Melanoms in Ergänzung des einheitlichen onkologischen Basisdatensatzes der Arbeitsgemeinschaft Deutscher Tumorzentren e. V. (ADT) und der Gesellschaft der epidemiologischen Krebsregister in Deutschland e. V. (GEKID) vom 25. Mai 2020. BAnz AT. 26.06.2020;(B4):1-4.
[11] Bundesministerium für Gesundheit. Bekanntmachung: Aktualisierter einheitlicher onkologischer Basisdatensatz der Arbeitsgemeinschaft Deutscher Tumorzentren e.V. (ADT) und der Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (GEKID) vom 10. Mai 2021. BAnz AT. 12.07.2021;(B4):1-31.
[12] Bundesregierung. Gesetz zur Zusammenführung von Krebsregisterdaten. 2021.
[13] Meisegeier S, Imhoff M, Berg K, Kraywinkel K. Bundesweiter klinischer Krebsregisterdatensatz – Datenschema und Klassifikationen (oBDS_v3.0.0.8a_RKI). Zenodo; 2023. DOI: 10.5281/zenodo.10022040
[14] Arbeitsgemeinschaft Deutscher Tumorzentren e.V. Die ADT als Vertrauensstelle für Bundesweite Qualitätskonferenzen in der Onkologie. [last accessed 2024 Dec 13]. Available from: https://adt-netzwerk.de/Vertrauensstelle/Bundesweite_Qualitaetskonferenzen/
[15] Roessler M, Schmitt J, Bobeth C, Gerken M, Kleihues-van Tol K, Reissfelder C, Rau BM, Distler M, Piso P, Günster C, Klinkhammer-Schalke M, Schoffer O, Bierbaum V. Is treatment in certified cancer centers related to better survival in patients with pancreatic cancer? Evidence from a large German cohort study. BMC Cancer. 2022 Jun;22(1):621. DOI: 10.1186/s12885-022-09731-w
[16] Rudolph C, Germer S, Nennecke A, Kusche H, Labohm L, Rath N, Rausch K, Holleczek B, Handels H, Katalinic A. Künstliche Intelligenz (KI) in der Krebsregistrierung: Methoden, Herausforderungen und erste Ergebnisse des AI-Care-Datensatzes. In: Gesundheit – gemeinsam. Kooperationstagung der Deutschen Gesellschaft für Medizinische Informatik, Biometrie und Epidemiologie (GMDS), Deutschen Gesellschaft für Sozialmedizin und Prävention (DGSMP), Deutschen Gesellschaft für Epidemiologie (DGEpi), Deutschen Gesellschaft für Medizinische Soziologie (DGMS) und der Deutschen Gesellschaft für Public Health (DGPH). Dresden, 08.-13.09.2024. Düsseldorf: German Medical Science GMS Publishing House; 2024. DocAbstr. 867. DOI: 10.3205/24gmds742
[17] Stegmaier C, Hentschel S, Hofstädter F, Katalinic A, Tillack A, Klinkhammer-Schalke M, editors. Das Manual der Krebsregistrierung. München: Zuckschwerdt; 2019.
[18] Operationen- und Prozedurenschlüssel (OPS). [last accessed 2024 Jan 24]. Available from: https://www.bfarm.de/DE/Kodiersysteme/Klassifikationen/OPS-ICHI/OPS/_node.html
[19] R Core Team. R: A language and environment for statistical computing. Vienna, Austria: R Foundation for Statistical Computing; 2022.
[20] Therapie des Lungenkarzinoms – eine Versorgungsforschungsstudie auf Basis von Krebsregisterdaten nach § 65c SGB V. DRKS00025080. In: Deutsches Register Klinischer Studien (DRKS). [last accessed 2024 Jan 24]. Available from: https://drks.de/search/de/trial/DRKS00025080
[21] Giusti F, Martos C, Trama A, Bettio M, Sanvisens A, Audisio R, Arndt V, Francisci S, Dochez C, Ribes J, Fernández LP, Gavin A, Gatta G, Marcos-Gragera R, Lievens Y, Allemani C, De Angelis R, Visser O, Van Eycken L; ENCR Working Group on Treatment Data Harmonisation. Cancer treatment data available in European cancer registries: Where are we and where are we going? Front Oncol. 2023;13:1109978. DOI: 10.3389/fonc.2023.1109978
[22] Institut für Krebsepidemiologie e.V. (IKE) der Universität zu Lübeck. KI-unterstützte, versorgungsnahe Nutzung von Krebsregisterdaten – AI-CARE. [last accessed 2024 Dec 6]. Available from: https://ai-care-cancer.de/
[23] Bei Y, Chen X, Raturi VP, Liu K, Ye S, Xu Q, Lu M. Treatment patterns and outcomes change in early-stage non-small cell lung cancer in octogenarians and older: a SEER database analysis. Aging Clin Exp Res. 2021 Jan;33(1):147-56. DOI: 10.1007/s40520-020-01517-z
[24] Ganti AK, Klein AB, Cotarla I, Seal B, Chou E. Update of Incidence, Prevalence, Survival, and Initial Treatment in Patients With Non-Small Cell Lung Cancer in the US. JAMA Oncol. 2021 Dec;7(12):1824-32. DOI: 10.1001/jamaoncol.2021.4932
[25] Zemanova M, Pirker R, Petruzelka L, Zbozínkova Z, Jovanovic D, Rajer M, Bogos K, Purkalne G, Ceriman V, Chaudhary S, Richter I, Kufa J, Jakubikova L, Zemaitis M, Cernovska M, Koubkova L, Vilasova Z, Dieckmann K, Farkas A, Spasic J, Fröhlich K, Tiefenbacher A, Hollosi V, Kultan J, Kolarová I, Votruba J. Care of patients with non-small-cell lung cancer stage III – the Central European real-world experience. Radiol Oncol. 2020 May;54(2):209-20. DOI: 10.2478/raon-2020-0026
[26] Krebsregister Baden-Württemberg. Krebsregistrierung in Baden-Württemberg: Datenkatalog mit Merkmalsausprägungen nach ADT/GEKID Basisdatensatz 2.0.0 für Tumorzentren, Onkologische Schwerpunkte, Krankenhäuser und niedergelassene Ärzte. 2017.
[27] Krebsregister Schleswig-Holstein. Meldepflicht – Mindestangaben (zwingend notwendige Angaben zur Erfüllung der Vollständigkeit einer Meldung und zur Auszahlung der Meldevergütung). 2018.
[28] Landeskrebsregister NRW. Melder-Broschüre Krebsregistrierung in Nordrhein-Westfalen: Meldepflicht – Meldepflichtige Erkrankungen – Vergütung. Bochum; 2020.
[29] Martin ML, Chung H, Rydén A. Willingness to report treatment-related symptoms of immunotherapy among patients with non-small cell lung cancer. Qual Life Res. 2022 Apr;31(4):1147-55. DOI: 10.1007/s11136-021-02966-3
[30] Yang DX, Khera R, Miccio JA, Jairam V, Chang E, Yu JB, Park HS, Krumholz HM, Aneja S. Prevalence of Missing Data in the National Cancer Database and Association With Overall Survival. JAMA Netw Open. 2021 Mar;4(3):e211793. DOI: 10.1001/jamanetworkopen.2021.1793
[31] SEER Acknowledgment of Treatment Data Limitations. For the 1975-2019 Data (November 2021 Submission). [last accessed 2023 Dec 14]. Available from: https://seer.cancer.gov/data-software/documentation/seerstat/nov2021/treatment-limitations-nov2021.html
[32] Du XL, Key CR, Dickie L, Darling R, Delclos GL, Waller K, Zhang D. Information on chemotherapy and hormone therapy from tumor registry had moderate agreement with chart reviews. J Clin Epidemiol. 2006 Jan;59(1):53-60. DOI: 10.1016/j.jclinepi.2005.06.002
[33] Noone AM, Lund JL, Mariotto A, Cronin K, McNeel T, Deapen D, Warren JL. Comparison of SEER Treatment Data With Medicare Claims. Med Care. 2016 Sep;54(9):e55-64. DOI: 10.1097/MLR.0000000000000073
[34] EGFR-mutiertes (EGFRmut) NSCLC: Zulassung für Osimertinib firstline. Im Focus Onkologie. 2018;21(7):80. DOI: 10.1007/s15015-018-4126-4
[35] Zulassung für Opdivo(R) / Yervoy(R): Erstlinie für NSCLC. Dtsch Ärztebl. 2020 Nov;117(Suppl. Pneumologie & Allergologie 2):40.
[36] Nicht-interventionelle Studie (Anwendungsbeobachtung) NIS-Nr.: 356. CRISP – Clinical Research platform Into molecular testing, treatment and outcome of (non-)Small cell lung carcinoma Patients. [last accessed 2023 Dec 14]. Available from: https://www.pei.de/SharedDocs/awb/nis-0301-0400/0356.html